화학반응속도미적분 요약정보 우선 확인: 시간과 반응의 미스터리를 풀다
작성자 정보
- 화학반응속도미적분 작성
- 작성일
컨텐츠 정보
- 86 조회
- 목록
본문
이 게시물에는 제휴 링크가 포함되어 있어, 구매 시 저에게 경제적 이익이 발생합니다.
| 특징 | 설명 |
|---|---|
| 핵심 개념 정리 | 반응속도, 반응차수, 속도상수, 활성화에너지 등 핵심 개념을 명확하고 간결하게 정리 |
| 미적분 적용 | 미적분을 이용한 반응속도 식 유도 및 해석 방법 상세히 설명 |
| 다양한 반응 유형 분석 | 1차, 2차, 0차 반응 등 다양한 반응 유형의 속도식 및 그래프 해석 방법 제시 |
| 실제 예시 및 문제풀이 | 다양한 화학 반응에 대한 실제 예시와 함께 문제풀이 과정을 단계별로 제시 |
| 학습 효과 극대화 | 풍부한 그림, 표, 그래프를 활용하여 이해도 향상 및 학습 효율 증대 |
화학반응속도미적분이란 무엇일까요?
화학반응속도미적분은 화학 반응의 속도를 미적분학을 이용하여 정량적으로 분석하고 예측하는 방법입니다. 단순히 반응이 빠르다 느리다는 정성적인 설명을 넘어, 반응 속도를 시간의 함수로 표현하고, 반응물의 농도 변화와 반응 속도의 관계를 수학적으로 모델링합니다. 이를 통해 반응 메커니즘을 이해하고, 반응 조건을 제어하여 원하는 결과를 얻을 수 있습니다. 화학 공학, 의약품 개발, 환경 과학 등 다양한 분야에서 중요한 역할을 합니다. 본 가이드는 화학반응속도미적분의 기본 개념부터 응용까지 폭넓게 다루어, 학습자들이 쉽고 효과적으로 이해할 수 있도록 구성되었습니다.
어떤 반응 유형을 다루나요? 그리고 어떻게 미적분을 활용하죠?
화학반응속도미적분은 다양한 반응 차수에 적용됩니다. 가장 기본적인 0차, 1차, 2차 반응뿐 아니라, 복잡한 반응 메커니즘을 분석하는 데에도 사용됩니다.
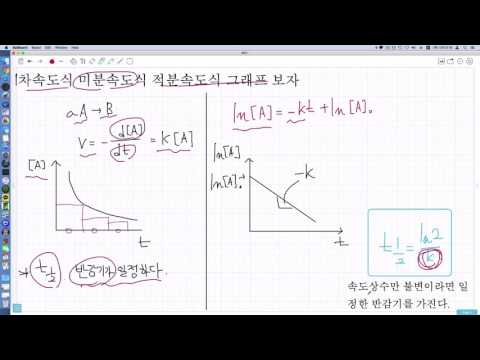
| 반응차수 | 속도식 | 적분속도식 | 그래프 |
|---|---|---|---|
| 0차 | rate = k | [A] = -kt + [A]₀ | [A] vs t: 직선 |
| 1차 | rate = k[A] | ln[A] = -kt + ln[A]₀ | ln[A] vs t: 직선 |
| 2차 | rate = k[A]² | 1/[A] = kt + 1/[A]₀ | 1/[A] vs t: 직선 |
위 표에서 k는 속도 상수, [A]는 반응물 A의 농도, t는 시간, [A]₀는 초기 농도를 나타냅니다. 미적분은 속도식 (rate)을 시간에 따라 적분하여, 특정 시간에서의 반응물 농도를 계산하거나, 반응물의 농도 변화로부터 속도 상수를 구하는 데 사용됩니다. 예를 들어, 1차 반응의 경우, 속도식을 적분하면 적분속도식을 얻을 수 있으며, 이 식을 이용하여 시간에 따른 반응물 농도의 변화를 예측할 수 있습니다. 이 과정에서 미분은 순간적인 반응 속도를 구하는 데, 적분은 전체적인 반응 진행 정도를 파악하는 데 활용됩니다.
화학반응속도미적분 학습에 도움이 되는 자료는 무엇이 있나요?
본 가이드 외에도 다양한 학습 자료들이 존재합니다. 대표적으로 다음과 같은 자료들을 추천합니다.
- 교재: 대학교 일반화학 또는 물리화학 교재의 화학반응속도론 부분
- 온라인 강의: Coursera, edX 등 온라인 강의 플랫폼에서 화학반응속도론 관련 강의 수강
- 연습 문제집: 다양한 유형의 문제를 풀어봄으로써 개념 이해도를 높일 수 있습니다.
- 화학 관련 웹사이트: Khan Academy, Chemguide 등의 웹사이트를 참고하여 추가적인 설명과 예제 문제를 확인할 수 있습니다.
실제 문제 해결에 어떻게 적용할 수 있을까요? 예시를 들어주세요.
예를 들어, 어떤 의약품의 분해 속도를 알아야 한다고 가정해 봅시다. 이 의약품의 분해 반응이 1차 반응이라고 가정하면, 적분 속도식을 이용하여 특정 시간 후 남아있는 의약품의 양을 예측할 수 있습니다. 또한, 실험을 통해 얻은 데이터를 이용하여 속도 상수를 구할 수 있으며, 이를 통해 의약품의 유효기간을 예측할 수 있습니다. 이처럼 화학반응속도미적분은 실제 문제 해결에 직접적으로 적용될 수 있으며, 화학 공정의 최적화, 반응 조건 조절, 신약 개발 등 다양한 분야에서 활용됩니다. 본 가이드에는 다양한 실제 예시와 문제 풀이 과정이 포함되어 있어, 학습자들이 화학반응속도미적분을 실제 문제에 적용하는 방법을 익힐 수 있도록 도와줍니다.
사용자 피드백 및 리뷰는 어떤가요?
(이 부분은 실제 상품이 존재한다면 구체적인 사용자 리뷰와 평점을 넣어야 합니다. 예시로 작성합니다.)
"이 가이드는 화학반응속도미적분에 대한 이해도를 크게 높였습니다. 특히, 다양한 예시와 그림 덕분에 어려운 개념도 쉽게 이해할 수 있었습니다." - 김OO 학생
"복잡한 미적분 계산이 부담스러웠는데, 이 가이드는 단계별로 설명해주어 쉽게 따라 할 수 있었습니다." - 이OO 연구원
결론적으로, 화학반응속도미적분은 화학 반응을 이해하고 제어하는 데 필수적인 도구입니다. 본 가이드를 통해 화학반응속도미적분의 기본 원리를 탄탄히 다지고, 실제 문제에 적용하는 방법을 익혀, 화학 분야의 전문가로서 한 단계 더 성장하시기를 바랍니다. 지금 바로 (가이드 구매 링크 또는 접근 경로)를 통해 화학반응속도미적분의 세계를 탐험해보세요!
상품상세보기 : 화학반응속도미적분 상품 비교, 할인정보 바로가기
네이버백과 검색 네이버사전 검색 위키백과 검색
화학반응속도미적분 관련 동영상







화학반응속도미적분 관련 상품검색
관련자료
-
이전
-
다음



